Steuerung und Inhalte der Flash-Animation
Die Animation kann über den Cursor oder die Tastatur gesteuert werden. Die Teilschritte der Reaktion werden hier per Screenshot vorgestellt und kurz erläutert.
Steuerung der Animation
Die Flash-Animation kann mithilfe der Maus durch Anklicken der Buttons und des Schalters gesteuert werden. Alternativ kann dafür aber auch die Tastatur des Rechners genutzt werden. Diese Möglichkeit unterstützt insbesondere die "mausfreie" Präsentation während des Unterrichtsgesprächs durch die Lehrperson oder im Rahmen eines Schülervortrags. Hier die verschiedenen Steuerungsfunktionen im Überblick:
Buttons (Animation)
Für Start und Stopp der Animation können die für diese Funktionen üblichen Icons in der Flash-Folie verwendet werden.Ein-und Ausschalter (Animation)
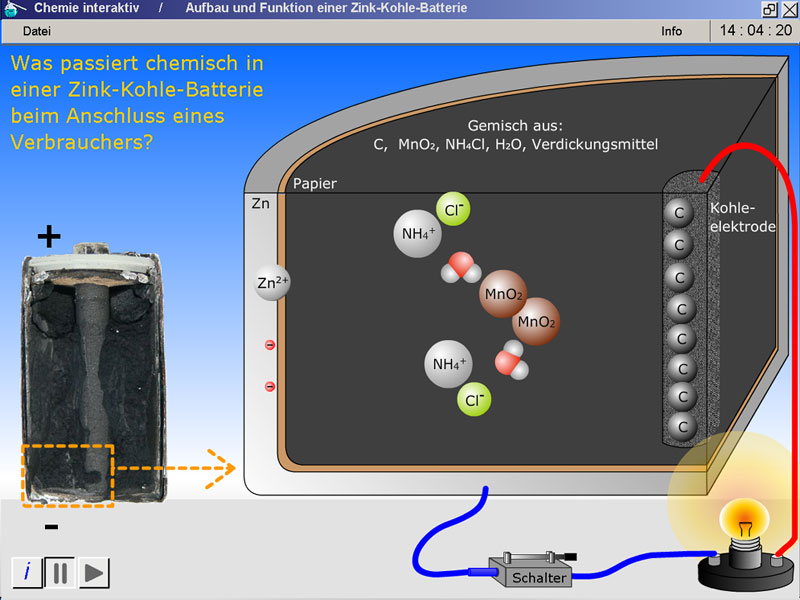
Über die Betätigung des Ein- und Ausschalters neben der Glühlampe (Abb. 1, Platzhalter bitte anklicken) startet man die Animation oder setzt sie zurück ("Reset").Computer-Tastatur
Alternativ zu den Buttons kann auch die Space-Taste der Tastatur zum Starten oder Stoppen der Animation genutzt werden. Mit den Pfeiltasten der Tastatur können Sie die Animation schrittweise vor oder auch zurücklaufen lassen.
Vorbemerkung zu den Elektronen
Die Animation beginnt mit der Bewegung zweier Elektronen (Abb. 1, Platzhalter bitte anklicken) über den elektrischen Leiter hin zum Verbraucher. Es ist sehr wichtig, dass die Lehrperson den Schülerinnen und Schülern hier klarmacht, dass diese beiden Elektronen in dem Modell nur exemplarisch dargestellt und bewegt werden. In Wirklichkeit fließen im gesamten Leiter Elektronen vom Minus- zum Pluspol.
Oxidation
Die Elektronen entstehen bei der Oxidation von Zinkatomen des Zinkbechers. Daraus lässt sich die erste Teilgleichung (Oxidation von Zink) ableiten: Zn (s) → Zn2+ (aq) + 2 e-
Reduktion
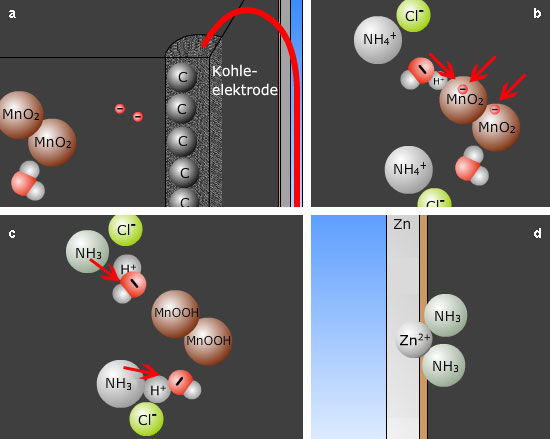
- Die Elektronen wandern über die Kohleelektrode in das leitfähige Gemisch aus Kohlenstoff und Braunstein (Abb. 2a).
- Dort wird Mangan(IV)dioxid reduziert. Unter Aufnahme eines Protons entsteht Mangan(III)oxidhydroxid (Abb. 2b): 2 MnO2 (s) + 2 H2O (l) + 2e- → 2 MnO(OH) (s) + 2 OH- (aq)
- Die Ammonium-Ionen geben jeweils ein Proton an Hydroxid-Ionen ab (Abb. 2c): 2 OH- (aq) + 2 NH4+ (aq) → 2 H2O (l) + 2 NH3 (g)
- Ammoniak diffundiert innerhalb in der Batterie und bildet mit den bei der Oxidation des Zinkbechers entstandenen Zink-Ionen Aminkomplexe (Abb. 2d): Zn2+ (aq) + 2 NH3 (g) → [Zn(NH3)2]2+ (aq)
Alterung der Batterie
Folgende Sekundärreaktionen führen zur Auflösung des Zinkbechers und somit zur Alterung der Batterie:
- Zn2+ (aq) + 2 OH- → Zn(OH)2 (s)
- Zn(OH)2 (s) → ZnO (s) + H2O (l)
Weiterlesen
- GDCh-Wochenschau-Artikel zum Thema
Bei der Behandlung des Themas bietet sich ein Blick auf weitere Batterietypen an: klassischer Bleiakkumulator und die junge Technologie der Lithium-Ionen-Batterie.