Modul 2: Lernumgebung "Reverse Transkriptase"
Die Lernumgebung ermöglicht die Untersuchung von Struktur und Funktion sowie der Wechselwirkung des Enzyms mit einem kompetitiven und einem allosterischen Hemmstoff.
Inhalte der Lernumgebung - Übersicht
Die dynamischen Folien sind in einer didaktischen Reihenfolge angeordnet. Nach dem Aufbau der Reversen Transkriptase aus zwei Untereinheiten werden die verschiedenen enzymatischen Funktionen dargestellt:
- Bindung des RNA-Einzelstrangs
- Ergänzung zum RNA-DNA-Hybridmolekül (Polymerase-Funktion)
- Abbau des RNA-Strangs (Nuklease-Funktion)
- Ergänzung des DNA-Einzelstrangs zum DNA-Doppelstrang (Polymerase-Funktion)
Hemmstoffe
Die weiteren Folien zeigen die Bindung von zwei verschiedenen Anti-AIDS-Wirkstoffen an das Enzym - einem kompetitiven und einem allosterischen Hemmstoff. Die Folien folgen in ihrer Reihung somit dem forschend-entwickelnden Gedankengang. Die Inhalte der Lernumgebung werden nachfolgend im Detail kommentiert.Inhaltsverzeichnis und Navigation
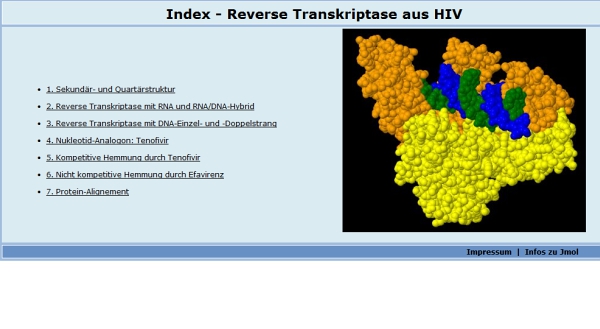
Auf der Startseite der Lernumgebung (Abb. 2, Platzhalter bitte anklicken) finden Sie eine Übersicht der Folien oder Seiten. Von hier aus kann jede Seite gezielt angesteuert werden. Über Navigationspfeile auf den Seiten (oben und unten rechts) kann auf die jeweils vorherige oder nachfolgende Folie gewechselt werden. Über das "Blatt"-Icon (oben rechts) gelangt man von jeder Folie zurück auf die Startseite (siehe Abb. 1).
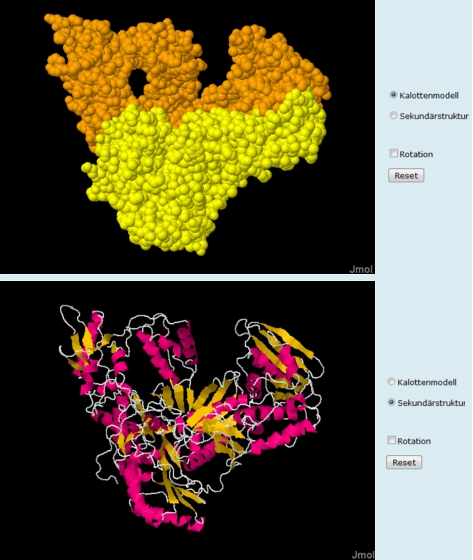
Sekundär- und Quartärstruktur (Folie 1)
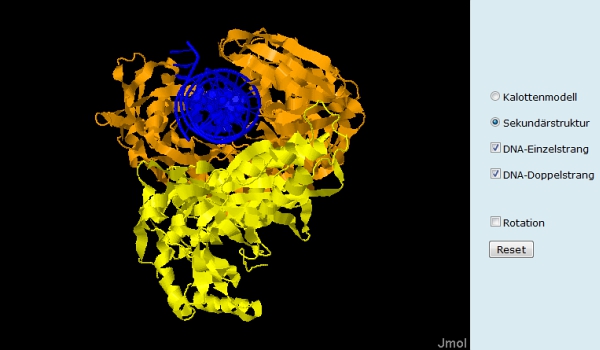
Das Enzym Reverse Transkriptase besteht aus zwei Untereinheiten (gelb und orange, Abb. 3 oben). Das funktionsfähige Protein liegt also in einer Quartärstruktur vor. Per Klick auf den Button "Sekundärstruktur" wechselt die Darstellung. Nun wird die Verteilung von ß-Faltblättern (gelb) und ?-Helices (magenta) im Enzym sichtbar (Abb. 3 unten). Das Molekül kann bei gedrückter linker Maustaste mit dem Mauszeiger "angefasst" und gedreht werden. Mit dem Scrollrad der Maus kann in die Struktur hinein- und herausgezoomt werden. Eine automatisierte Drehung des Moleküls erfolgt nach Anklicken des Buttons "Rotation".
Funktion der Reversen Transkriptase (Folien 2 und 3)
Polymerase und Nuklease
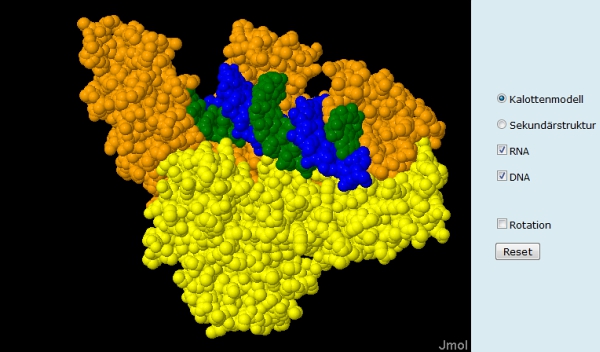
Über das Steuerungsmenü von Folie 2 lassen sich die virale RNA und ein DNA Einzelstrang im Enzym anzeigen (Abb. 4) und ausblenden. (Natürlich ist in der Darstellung nur ein Bruchteil des viralen Genoms sichtbar.) Diese Funktionen können am Beamer dazu genutzt werden, während des Unterrichtsgesprächs die Bindung des RNA-Einzelstrangs (grün), die Bildung des DNA/RNA-Hybrids (Polymerase-Funktion) und den Abbau des RNA-Strangs (Nuklease-Funktion) zu simulieren.Aktive Zentren
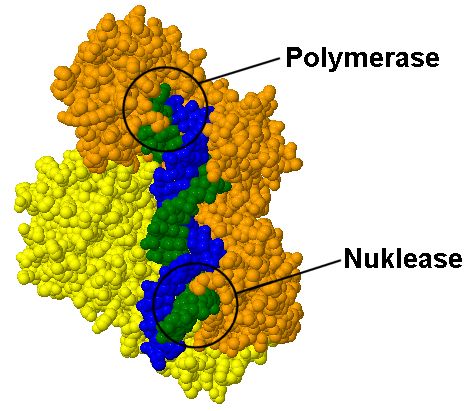
Ein Pop-up-Fenster (Abb. 5), das über einen Link in dem Textblock über dem Molekülmodell von Folie 2 geöffnet werden kann, zeigt die Lokalisation der Polymerase- und der Nuclease-Funktion in dem viralen Protein. Die beiden aktiven Zentren befinden sich an den gegenüberliegenden Enden der Bindungsfurche an der Proteinoberfläche.Doppelstrang-DNA
Die Neusynthese eines zum DNA-Einzelstrang komplementären zweiten DNA-Strangs (beide blau) kann auf Folie 3 nachvollzogen werden. Die Starteinstellung des Applets zeigt einen DNA-Einzelstrang in der Bindungstasche des Enzyms. Per Klick auf "DNA-Doppelstrang" kann der zweite Polymeraseschritt des Enzyms simuliert werden. Auch auf den Folien 2 und 3 können Schülerinnen und Schüler zwischen der Darstellung im Kalottenmodell und der Sekundärstruktur wählen. Je nach Darstellungsart lassen sich so unterschiedliche strukturelle Zusammenhänge besser erkennen. In der Sekundärstruktur ist zum Beispiel sehr schön zu erkennen, wie das Enzym den DNA-Doppelstrang "im Griff" hat (Abb. 6). Es verdeutlicht den Lernenden, dass Enzyme keine plumpen Bauklötze sind, sondern ausgeklügelte Hochleistungs-Nanomaschinen.Ein kompetitiver Hemmstoff (Folie 4 und 5)
Das Nucleotid-Analoglon Tenofovir
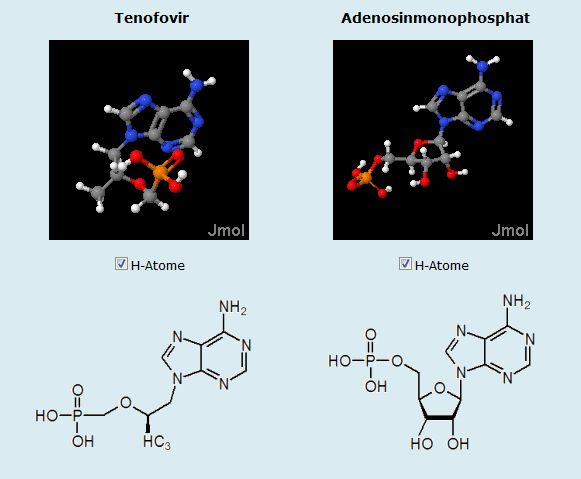
Die Bedeutung des Begriffs "Nucleotid-Analogon" wird den Schülerinnen und Schülern auf Folie 4 deutlich (Abb. 7). Hier stehen Tenofovir und Adenosinmonophosphat (AMP) nebeneinander. Ihr ähnlicher Aufbau lässt bereits vermuten, dass die Hemmung kompetitiv, also im Wettbewerb um den Bindungsplatz im aktiven Zentrum des Enzyms, stattfindet. Tenofovir wird nach der Aufnahme in die Zelle phosphoryliert und konkurriert mit den natürlichen Substraten um die Nukleotidbindungsstelle der Reversen Transkriptase. Eine genauere Betrachtung der Strukturformeln unterhalb der Applets führt auf die Spur des Wirkungsmechanismus: Die Verlängerung der Nukleotidketten erfolgt über die 3'-OH-Gruppe am Fünferring des Ribose-Bausteins. Tenofovir fehlt eine solche Gruppe. Daher verursacht es den Abbruch der Synthesereaktion.Bindung an das Enzym
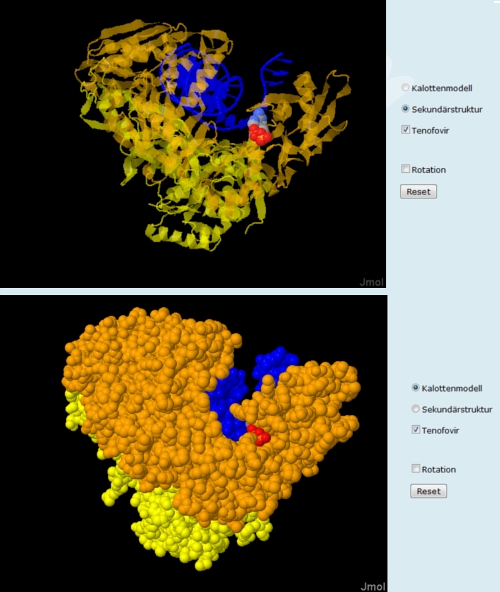
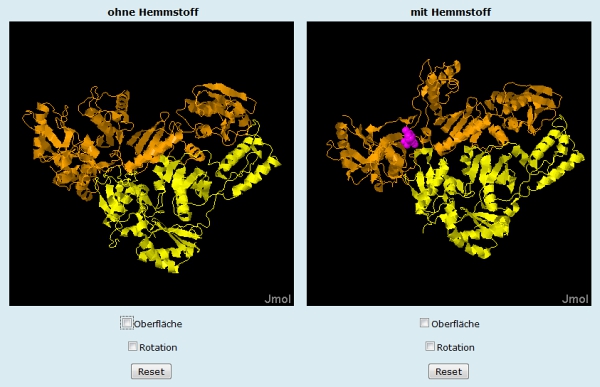
Folie 5 zeigt, wie tief Tenofovir in die Bindungstasche eindringt. In der transparenten Sekundärstrukturdarstellung (Abb. 8, oben) des Enzyms (gelb/orange) und der Draht-Darstellung der Nukleinsäure (blau) ist Tenofovir als Kalottenmodell im Standard-Farbschema der Elemente vollständig zu erkennen (Sauerstoff rot, Phosphor orange). Bei der Darstellung des Proteins als Kalottenmodell wird deutlich, wie tief der Hemmstoff in die Bindungstasche vordringt (Abb. 8, unten).Ein nicht kompetitiver Hemmstoff (Folie 6 und 7)
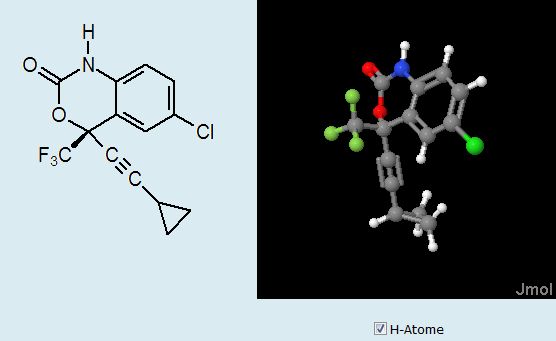
Efavirenz
Das HIV-Medikament Efavirenz wirkt nicht kompetitiv als Hemmstoff auf die Reverse Transkriptase. Ein Pop-up-Fenster (Abb. 9) von Folie 6 zeigt, dass der Hemmstoff keine strukturelle Ähnlichkeit mit den natürlichen Substraten der Reversen Transkriptase hat.Hemmung durch Strukturänderung
Efavirenz bindet an einer Stelle außerhalb der aktiven Zentren des Enzyms. Seine Bindung verursacht eine Konformationsänderung der Reversen Transkriptase. Diese Strukturverschiebung sorgt dafür, dass der Zugang der Substrate zum aktiven Zentrum behindert und somit die Polymerase-Aktivität des Enzyms gehemmt ist. Dieser Effekt ist auf Folie 6 dargestellt (Abb. 10). Der Hemmstoff ist magentafarbig dargestellt.Übereinandergelegte Proteinketten
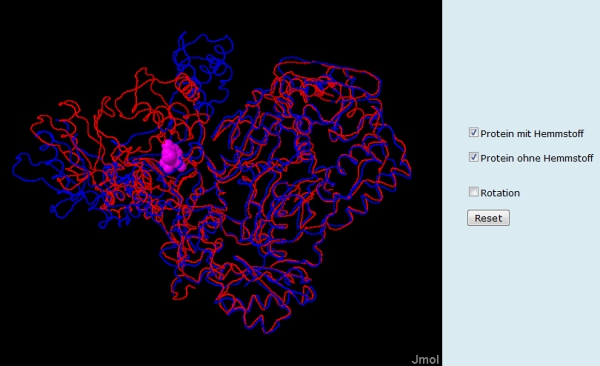
Eine hilfreiche Methode der "Computerbiologie" ist das sogenannte Alignement dreidimensionaler Strukturen. Konformationsänderungen, die durch die Bindung eines Linganden - Substrat oder Hemmstoff - verursacht werden, treten dabei besonders deutlich hervor. Diese Möglichkeit wird auf Folie 7 genutzt (Abb. 11). Die rote Kette zeigt das Rückgrat der Reversen Transkriptase ohne Hemmstoff, die blaue Kette nach der Bindung des Hemmstoffs. Über die Buttons können beide Darstellungen einzeln aufgerufen oder weggeklickt werden.Weitere Einsatzmöglichkeiten der Lernumgebung
Kompetitive und nicht kompetitive Hemmung des gleichen Enzyms
Die dynamischen Folien zur Reversen Transkriptase und ihren Hemmstoffen lassen sich nicht nur im Rahmen des Unterrichts zum Thema HIV einsetzen. Die Unterseiten zu Efavirenz und Tenofovir können schon früher im Bereich der Stoffwechselphysiologie eingesetzt werden. Es handelt sich um eindrucksvolle und gut erkennbare Beispiele für Enzymhemmungen. Kompetitive (Tenofovir) und nicht kompetitive (Efavirenz) Enzymhemmung können sehr gut gegenüber gestellt und voneinander abgegrenzt werden. Neben der guten Sichtbarkeit der Wirkprinzipien bieten diese Beispiele einen weiteren Vorteil: Sie sind für Schülerinnen und Schüler sicher interessanter als die häufig in Schulbüchern verwendeten Beispiele. Mit einer kleinen Hintergrundinformation, welche Bedeutung die Reverse Transkriptase für die Bekämpfung von AIDS hat, erscheinen die betrachteten Hemmstoffe gleich viel interessanter als eine gehemmte Succinatdehydrogenase. Hinzu kommt noch, dass beide Hemmungstypen am gleichen Enzym gezeigt werden können.Strukturebenen im Proteinaufbau
Die erste Folie der Lernumgebung (Abb. 3) bietet Schülerinnen und Schüler die Möglichkeit, ß-Faltblätter und ?-Helices dreidimensional erfahren zu können. Zwar werden die Sekundärstrukturelemente eines Proteins in ihrem Aufbau intensiv besprochen und gerne abgefragt. Häufig fällt es den Lernenden jedoch schwer, sich diese Strukturen vorzustellen. Durch das Drehen des interaktiven Makromoleküls am Monitor wird die Sekundärstruktur viel besser begreifbar. Gleiches gilt auch für die Quartärstruktur. Am Beispiel der Reversen Transkriptase sehen die Schülerinnen und Schüler direkt, was es bedeutet, wenn ein Enzym aus verschiedenen Untereinheiten aufgebaut ist.Online-Lernumgebung
- Reverse Transkriptase aus HIV
Die Seiten mit interaktiven Molekülmodellen können das Unterrichtsgespräch per Beamer unterstützen oder von den Lernenden am Rechner genutzt werden.
Weiterlesen
- Modul 3: AIDS-Virus mit stumpfem Stachel
Aktuelle Zahlen belegen, dass AIDS längst nicht besiegt ist. Warum ist der Kampf gegen HIV so schwierig? Und wie können neuartige Medikamente wirken?