Wechselwirkungen der alpha-Helix
Betrachtung der Amphiphilie einer alpha-Helix mit Bezug zum Tertiärstruktur-Kontext.
Eine Grenzflächenhelix unter der "Lupe"
Während sich die Darstellungen zum Thema "Sekundärstrukturen" vor allem mit dem allgemeinen Architekturprinzip der alpha-Helix und den intrahelikalen Wasserstoffbrücken beschäftigten, veranschaulichen die Module dieses Abschnitts die Wechselwirkungen der helikalen Aminosäurereste mit dem hydrophilen Medium und dem hydrophoben Proteinkern.
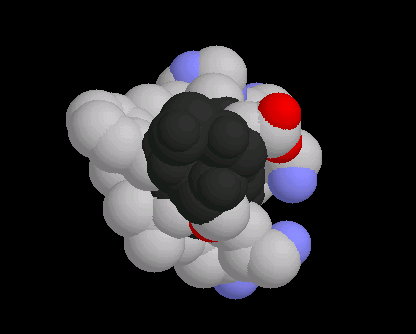
- Die erste Darstellung zeigt das raumfüllende Kalottenmodell eines "Grenzflächenhelix"-Abschnitts. Farblich hervorgehoben sind die Stickstoff- und Sauerstoffatome der Seitengruppen und des Rückgrats. Beim Drehen und Wenden der Helix ist zu erkennen, dass es sich um eine "amphiphile Helix" handelt, d.h., dass auf einer Seite hydrophobe Reste, auf der anderen dagegen hydrophile Reste (erkennbar an den Heteroatomen) aus der Achse hervorragen. Diese Eigenschaft spiegelt die Anpassung der Aminosäuresequenz (Primärstruktur) an ihre räumliche Position im Tertiärstrukturkontext wider: Die hydrophobe Seite der Helix geht mit dem hydrophoben Proteinkern hydrophobe (van-der-Waals-)Wechselwirkungen ein und stabilisiert so die Tertiärstruktur des Proteins. Die hydrophile Seite bildet dagegen Wasserstoffbrücken mit den Wassermolekülen der Umgebung. Dieses Hydratwasser trägt dazu bei, das Protein in Lösung zu halten.
- Deutlicher wird dieses Prinzip in der zweiten Darstellung, die die Heteroatome des Rückgrats ausblendet. Die beiden folgenden Module zeigen dieselbe Darstellung, nur bereits entsprechend den jeweiligen Textinformationen räumlich ausgerichtet. So zeigt zum Beispiel der Blick entlang der Helixachse noch einmal deutlich deren amphipatischen Charakter (Abb. 7): Sämtliche Heteroatome der Seitenketten befinden sich in dieser Ansicht auf der rechten Seite.
Weiterlesen
- Hydrophobizität, Polarität & Ladungen
Strukturprinzip löslicher globulärer Proteine.