Sichelzellen-Hämoglobin
Molekulare Pathologie der Polymerisation von Sichelzellen-Hämoglobin.
Kleine Ursache, fatale Wirkung!
Ursache der Sichelzellenanämie ist der Austausch eines einzigen Nukleotids im beta-Hämoglobinketten-Gen, wodurch die hydrophile Aminosäure Glutamat gegen die hydropobe Aminosäure Valin ersetzt wird. Mit fatalen Folgen: Der ausgetauschte Glutamatrest befindet sich nämlich an der Oberfläche des Proteins. Die Exposition des hydrophoben Restes setzt die Löslichkeit de Proteins vor allem im desoxygenierten Zustand stark herab und kann so die Polymerisation des Hämoglobins zu langen und unlöslichen Filamenten auslösen.
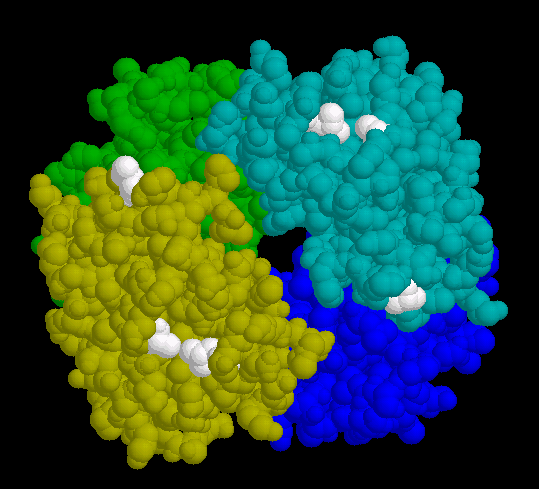
- Die erste Darstellung zeigt die Position des Valins auf der Oberfläche des oxygenierten Sichelzellen-Hämoglobins. Der so erzeugte "hydrophobe Fleck" ist weiß hervorgehoben.
- Die Desoxygenierung des Moleküls ist mit einer Konformationsänderung der Quartärstruktur verbunden, die einen zusätzlichen hydrophoben Bereich an die Oberfläche befördert (Abb. 9). Dieser ist auch beim "normalen" Hämoglobin vorhanden, wo er keinen negativen Effekt zeigt. Im Verbund mit dem neu hinzu gekommenen Valin-Rest verleiht er dem Molekül jedoch das Potenzial zur Polymerisation, sobald die Desoxy-Form eine kritische Konzentration überschreitet.
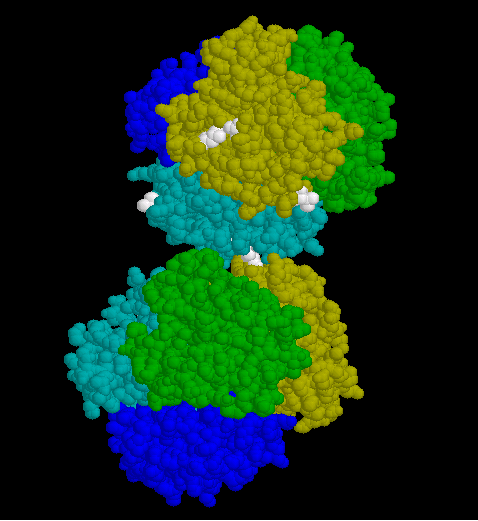
- Das nächste Modul zeigt den ersten Schritt der Polymerisation, die Dimerisierung zweier Moleküle über hydrophobe Wechselwirkungen (Abb. 10).
- Die an der Polymerisation beteiligten hydrophoben Reste und ihre Wechselwirkung wird erst dann deutlich, wenn die raumfüllende Darstellung durch die Rückgrate der Polypetidketten ersetzt wird.
- Die letzte Chime-Projektion zeigt eine Vergrößerung der Kontaktstellen.
Symptomatik der Sichelzellen-Anämie
Die für die Sichelzellenanämie charakteristischen sichelförmigen Erythrozyten sind fragiler als ihre "Wildtyp"-Pendants, was die anämische Symptomatik verursacht. Die exponierten hydrophoben Reste wirken wie "hydrophile Lego-Noppen" oder "sticky patches", über die die Proteine zu langen Filamenten polymerisieren und so den Erythrocyten eine sichelförmige Gestalt aufzwingen. Die Sichelzellen sind im Gegensatz zu den geschmeidig-biegsamen normalen Erythrozyten nicht mehr deformierbar und verstopfen unter Sauerstoffmangelbedingungen (Höhenaufhalte, Flugreisen, Narkosen) zunächst kleine und schließlich größere Gefäße, was dann lebensbedrohliche Komplikationen verursacht. Im homozygoten Zustand führte die Krankheit noch vor kurzem im frühen Kindesalter zum Tode. Heterozygote zeigen eine deutlich abgeschwächte Symptomatik. Die Krankheit kommt fast nur bei Afrikanern vor, die aus zentralafrikanischen Regionen mit hohen Malariavorkommen stammen. In einigen Regionen tragen fast 40 Prozent der dortigen Bevölkerung das "defekte" Gen. Die Ursache dafür liegt darin, dass das Sichelzellen-Hämoglobin den Malaria-Erregern Schwierigkeiten bereitet: Heterozygote sind gegen den Malaria-Erreger besser geschützt und haben daher gegenüber den homozygot "Gesunden" einen Selektionsvorteil. Dies zeigt deutlich, wie schmal der Grat zwischen "gesund" und "krank", "nützlich" und "schädlich", sein kann und wie wichtig die genetische Vielfalt des Genpools einer Spezies für dessen Überleben ist: Genetische "Randgruppen" können an bestimmten Orten - oder zu bestimmten Zeiten! - für das Überleben der Art eine unvorhersehbare Bedeutung erlangen.
Weiterlesen
- Informationen zu Chime
Tipps zur Arbeit mit dem Molekülbetrachter Chime