Peptide und zentrale Ketten
Einführung in die Darstellungsformen von Oligopeptidketten.
Aufbau eines Tetrapeptids
Wurden in dem vorausgegangenen Abschnitt die Darstellungsmöglichkeiten einer Aminosäure vorgestellt, werden diese hier auf ein Oligopeptid angewendet. Damit betritt man hier die Primärstruktur-Ebene. Als neue Darstellungsform wird schließlich das Polypeptidketten-Rückgrat vorgestellt (nicht zu verwechseln mit dem Aminosäure-Rückgrat).
- Zunächst wird die allgemeine Rückgrat-Struktur einer Aminosäure (ohne Seitenkette) dargestellt.
- Aus dieser Struktur wird das "allgemeingültige" Rückgrat eines Tripeptids aufgebaut.
- Die "anonymen" Einheiten werden durch Hinzufügen von Methylgruppen in ein Alanyl-alanin-alanin (Ala-Ala-Ala) umgewandelt. Um das ganze zunehmend komplexer zu machen, wird das Tripeptid in ein Lysyl-alanyl-alanin (Lys-Ala-Ala) und schließlich in ein Lysyl-alanyl-isoleucin (Lys-Ala-Ile) umgewandelt, bevor es zum Tetrapeptid ergänzt wird. Bis hierher folgen alle Darstellungen der "stick"-Struktur.
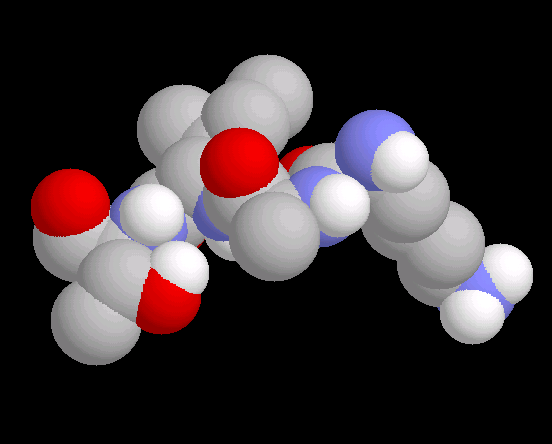
- Im Folgemodul haben die SchülerInnen die raumfüllende Darstellung des Tetrapeptids vor Augen (Abb. 2).
- Am Beispiel des Tetrapeptids wird nun verdeutlicht, wie die Biochemiker die Darstellung von Peptidketten abstrahieren, um bei der Strukturanalyse von Polypeptidketten aus mehreren Hundert Aminosäuren nicht "den Wald vor lauter Bäumen nicht mehr sehen zu können": In den beiden letzten Modulen wird daher die "Rückgrat"-Darstellung von Peptidketten eingeführt.
Weiterlesen
- Hämoglobin & Häm
Quartär- und Tertiärstruktur, Aufbau und Eigenschaften der Häm-Gruppe.