Hämoglobin & Häm
Quartär- und Tertiärstruktur, Aufbau und Eigenschaften der Häm-Gruppe.
Quartärstruktur
- Die erste Darstellung zeigt die Quartärstruktur des nativen Proteins mit farblich differenzierten Untereinheiten und den Häm-Komplexen (raumfüllende Darstellung, siehe Abb. 3).
- Das folgende Modul reduziert die Polypeptidketten auf ihr Rückgrat. Erst jetzt wird die Lage der Häm-Gruppen (raumfüllende Darstellung) klar erkennbar (und der Vorteil der diversen "Struktursprachen" deutlich).
Lassen Sie Ihre SchülerInnen durch die Drehung des Moleküls den zentralen Hohlraum entdecken, in dem der Hämoglobin-Ligand 2,3-Diphosphoglycerat (DPG) bindet und dabei über eine Änderung der Quartärstruktur die Sauerstoff-Affinität des Hämoglobins senkt (DPG stabilisiert die Konformation der Desoxy-Form, indem es die beiden beta-Ketten über ionische Wechselwirkungen miteinander vernetzt). DPG wird vom Körper in Höhenlagen gebildet, wo ein niedriger Sauerstoff-Partialdruck herrscht, und erleichtert dort die Abgabe von Sauerstoff an das atmende Gewebe.
Tertiärstruktur, Häm und Sauerstoffbindung
- Im den beiden Folgemodulen sind die Polypeptidketten komplett ausgeblendet. Das zweite der beiden Module stellt die Atomsorten der Hämgruppe farbkodiert dar. Die Lagebeziehungen der vier "freischwebenden" Häm-Gruppen verdeutlicht die tetraedrische Symmetrie (dreiseitige Pyramide) des Moleküls. Bei der Analyse der Symmetrie erweist sich wiederum das Anfassen und Drehen der Strukturen als hilfreich.
- Es folgt die vergrößerte Darstellung einer einzelnen Hämgruppe in raumfüllender Ansicht sowie
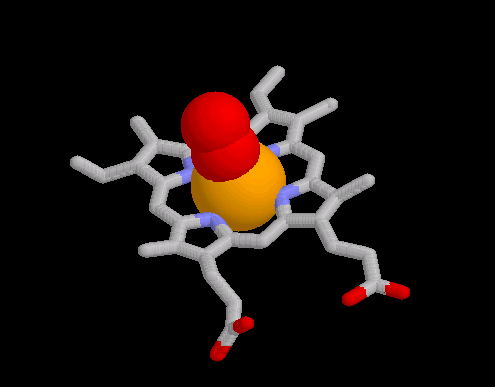
- eine Darstellung in der "stick"-Struktur, in der die Komplexbindung des zentralen Eisenatoms über die Stickstoffatome der Porphyrin-Struktur erkennbar wird. Die Besetzung der fünften Koordinationsstelle durch ein Histidin-Stickstoff der Polypeptidkette ist noch nicht berücksichtigt.
- An die sechste Koordinationsstelle wird nun molekularer Sauerstoff gebunden.
Dabei ist deutlich erkennbar, dass die Achse des Sauerstoffmoleküls nicht senkrecht auf die Ebene des Porphyrin-Ringes ausgerichtet ist (Abb. 4; siehe auch Abb. 5 der Hintergrundinformation zu den Eigenschaften der prosthetischen Gruppe).
- Nun geht es wieder vom Kleinen zum Großen: Das oxygenierte Häm wird wieder in die Globin-Kette eingefügt, zunächst in eine Rückgrat-, dann in eine raumfüllende Darstellung.
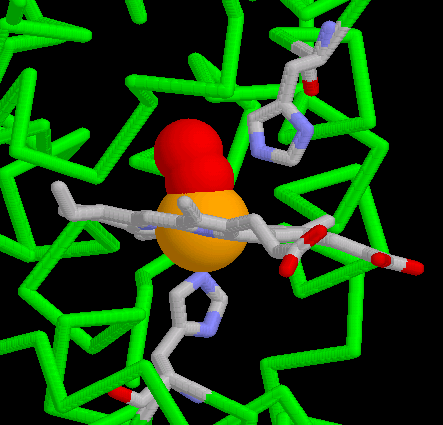
- Die beiden letzten Darstellung zum Thema "Sauerstoffbindung" zeigen ein weiteres Details der Häm-Einbettung in das Globin und der Sauerstoffbindung: Die Positionierung hydrophiler Teile des Häms an der Oberfläche und die Ausrichtung hydrophober Bereiche zum Proteininneren. Weiterhin kommt die Besetzung der fünften Koordinationsstelle durch das sogenannte "proximale Histidin" sowie die Lage des "distalen Histidins" über dem gebundenen Sauerstoff zur Darstellung. Mehr zur Bedeutung des distalen Histidins liefert der folgende Fachliche Kommentar.
Die Chime-Darstellungen heben einige Strukturmerkmale des Hämoglobins hervor, die sich zu den biochemischen Funktionen der Proteins sehr schön in Beziehung setzen lassen, auf die die vorgestellte Applikation jedoch nicht explizit hinweist. Auf der folgenden Seite finden Sie die wichtigsten Infos zu den Hämoglobin-Eigenschaften, die sich in diesen Strukturdetails abbilden:
Hintergrundinformation: Die Eigenschaften der prosthetischen Gruppe
Die Proteinumgebung definiert die katalytischen Eigenschaften
Warum benutzt die Natur nicht die "nackten" Hämgruppen für die Sauerstofflogistik, sondern wickelt sie in komplexe Poypeptidketten ein? Zum einen sind es die vielfältigen allosterischen Wechselwirkungen der Globine mit diversen Liganden, über die die Eigenschaften der Sauerstoffbindung durch das Häm sinnreich modelliert und den jeweiligen biologischen Erfordernissen perfekt angepasst werden - von der DPG-Bindung (siehe oben) bis hin zur Kooperativität der Sauerstoffbindung an die vier Untereinheiten des Hämoglobins. Die wichtigsten dieser "Stellschrauben" werden in Schulbüchern ausreichend thematisiert. Unberücksichtigt bleibt jedoch meist ein viel allgemeineres und enorm wichtiges Grundprinzip der Molekularbiologie und Biochemie: Die katalytischen Eigenschaften jeder prosthetischen Gruppe und jeden aktiven Zentrums werden maßgeblich von der Proteinumgebung geprägt, in die sie eingebettet sind. Man vergegenwärtige sich, dass das Häm, das im Hämoglobin zur reversiblen Sauerstoffbindung eingesetzt wird, im Atmungskettenenzym Cytochrom c als Elektronenüberträger verwendet wird! Wie die Globinkette die speziellen Bindungseigenschaften des Häms beeinflusst, wird nachfolgend an zwei Struktureigenschaften hervorgehoben, die in den Chime-Darstellungen sehr gut deutlich werden.Erst das Globin gewährleistet eine reversible Häm-Oxygenierung
Frei lösliche Hämgruppen mit einem komplexierten zweiwertigem Eisen-Ion könnten Sauerstoff nur für einen sehr kurzen Moment binden. Der Sauerstoff würde das zweiwertige Eisen schnell zu dreiwertigem Eisen oxidieren, das keinen Sauerstoff mehr binden kann. Ein Zwischenprodukt dieser Oxidation ist ein "Häm-Sauerstoff-Häm-Sandwich". Die Polypeptid-"Verpackung" der Hämgruppen verhindert dies und gewährleistet damit die Verwendbarkeit der Hämgruppen als Sauerstofftransporteure im Blut. Das letzte Modul zum Thema "Hämoglobin & Häm" verdeutlicht die Lage des Häms in seiner Bindungstasche, die die Bildung von Häm-Dimeren ausschließt.Kohlenmonoxid hat eine hohe Häm-Affinität
Kohlenmonoxid ist für uns ein toxisches Gas, weil es die Sauerstoffbindungsstellen des Hämoglobins vergiftet: Seine Affinität zum Hämoglobin-Eisen übertrifft die des Sauerstoffs um das 200-fache. Aus diesem Grund kann schon ein niedriger Kohlenmonoxid-Partialdruck tödliche Folgen haben. Am "nackten" Häm sähe der Vergleich noch ungünstiger aus: Zu diesem hat Kohlenmonoxid eine 25.000 mal höhere Affinität als Sauerstoff. Eine Eigenschaft, die das Pigment als Sauerstoffträger völlig unbrauchbar machen würde, denn Kohlenmonoxid ist nicht nur ein Industriebgas, sondern wird auch vom Organismus selbst erzeugt (es entsteht bei diversen katabolen Stoffwechselreakrtionen und dient auch als Botenstoff, zum Beispiel als bei der Regulation der glatten Gefäßmuskulatur). Unter normalen Umständen ist etwa ein Prozent unseres Hämoglobins mit endogen produziertem Kohlenmonoxid blockiert.Sterische Hinderung der Kohlenmonoxid-Bindung
Ohne die Reduktion der Kohlenmonoxid-Affinität um das 125-fache könnte wir mit unserem Blutfarbstoff kaum leben. Aber wie schafft die Polpeptidkette dieses Kunststück? Die Natur greift an der Geometrie der Komplexierung von Sauerstoff und Kohlenmonoxid an. Während die Achse des Sauerstoffmoleküls bei der Bindung an das Eisenatom einen 120 Grad-Winkel zur Häm-Ebene bildet, steht die Achse des Kohlenmonoxid-Moleküls - bei freiem Zugang zum Häm - exakt senkrecht auf dessen Ebene. Diesen optimalen Bindungswinkel verbaut die Polypeptidkette dem Kohlenmonoxid, indem es ihm in der Häm-Bindungstasche des Globins einen sperrigen Histidin-Rest in den Weg stellt (sterische Hinderung), der den Sauerstoff nicht weiter stört. Die Position des distalen Histidins wird in dem vorletzten Modul zum Thema "Hämoglobin & Häm" sehr schön deutlich (Abb. 5). Im unteren Bereich des Bildausschnitts ist das proximale Histidin zu erkennen. Das freie Elektronenpaar des Stickstoffatoms im Histidinring besetzt eine der Koordinationsstellen des Eisenions.Weiterlesen
- Sekundärstrukturen
Allgemeines Strukturprinzip der alpha-Helix.