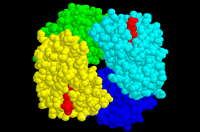
Die dreidimensionale Hämoglobinstruktur
Mithilfe des Chime-Molekülbetrachters werden am Hämoglobin Strukturhierarchien, intra- und intermolekulare Wechselwirkungen sowie die pathologischen Folgen genetisch bedingter Änderungen der Proteinstruktur untersucht.
Das schöne in der Biologie ist der strenge Zusammenhang zwischen Struktur und Funktion von der Nano- bis zur Makroebene: Die Analyse dreidimensionaler Strukturen erweist sich stets als aufschlussreich und ist weit mehr als eine bloße "Bildbeschau". Franz Josef Scharfenberg vom Richard-Wagner-Gymnasium in Bayreuth hat die dreidimensionalen Ausarbeitungen von Eric Martz (University of Massachusetts, USA) zu unserem Blutfarbstoff für den Einsatz im deutschsprachigen Unterricht aufbereitet. Die dreidimensionale Darstellung der Proteinstrukturen, die mithilfe des kostenlosen Plugins Chime mit der Maus nach Belieben angefasst, gedreht und herangezoomt werden können, zeigen, was schon Thomas Mann wusste (woher eigentlich? - schließlich gelang das erste Beugungsbild eines Proteins Dorothy Hodgkin erst 1932): Proteine sind "unhaltbar verwickelt und unhaltbar kunstreich aufgebaute Eiweißmolekel" (aus "Der Zauberberg").
Standardbeispiel und "Enzym honoris causa"
Es lohnt sich, einen genaueren Blick auf das Hämoglobin zu werfen. An diesem Beispiel lassen sich zahlreiche allgemeine Aspekte der Proteine und Enzyme herausarbeiten:
- Als oligomeres Protein bietet der Blutfarbstoff die Möglichkeit, alle Strukturhierarchien - von der Primär- bis zur Quartärstruktur - durchzuspielen.
- Von der Anordnung der Aminosäuren innerhalb der Untereinheiten - hydrophobe Aminosäureseitenketten an der Oberfläche, hydrophile im Inneren des Proteins - lässt sich leicht der Bogen zur thermodynamischen "driving force" des in der Primärstruktur kodierten Selbstfaltungsprozesses der Biopolymere schlagen.
- Hämoglobin ist zwar "nur" ein Transportprotein, seine in die Polypeptidketten eingebetteten Häm-Gruppen können jedoch - was die Architektur aktiver Zentren und die Modellierung ihrer katalytischen Aktivität betrifft - exemplarisch als prosthetische Gruppen der Enzyme betrachtet werden (schließlich wird Hämoglobin von Molekularbiologen gerne auch als "Enzym honoris causa" bezeichnet).
- Die auf dem Austausch einer einzigen Aminosäure basierende Sichelzellenanämie verdeutlicht stellvertretend für Erkrankungen wie Alzheimer oder BSE das Prinzip der auf Protein-Polymerisationen basierenden Erkrankungen.
Inhalte der Lernumgebung und technische Hinweise
Hämoglobin
- Wechselwirkungen der alpha-Helix
Betrachtung der Amphiphilie einer alpha-Helix mit Bezug zum Tertiärstruktur-Kontext.
Sichelzellen-Anämie
Technische Hinweise
Internetadressen
- Hämoglobin - Hemoglobin Structure in Jmol
Die deutschsprachige Version der Hämoglobin-Materialien ist zurzeit nicht erreichbar. Für die Nutzung dieser englischsprachigen Jmol-Version benötigen Sie statt des Pugins Chime lediglich Java Runtime Environment (kostenloser Download)
Plugin
- Symyx - Chime
Hier können Sie das Chime-Plugin kostenfrei downloaden. Zuvor müssen Sie sich bei Symyx registrieren lassen.